Τα εμφυτεύσιμα ικριώματα που χρησιμοποιούνται είναι τρισδιάστατες μικροδομημένες επιφάνειες πυριτίου που παράγονται με τη χρήση λέιζερ υπερταχέων παλμών [1], καθώς προσφέρουν ένα πιο ρεαλιστικό τοπικό μικρο-περιβάλλον για τη δραστηριότητα των κυττάρων, ενώ παρουσιάζουν σημαντικά πλεονεκτήματα, δεδομένου ότι το πυρίτιο: α) είναι ευέλικτο και ανεξάρτητο υλικό β) είναι ταχύ, εύκολα προσαρμόσιμο και επεκτάσιμο μέσω της παράλληλης επεξεργασίας, γ) επιτρέπει τη μοναδική δυνατότητα για ελεγχόμενα, υψηλής ανάλυσης χαρακτηριστικά τόσο στη μικρο- όσο και στη νανο-κλίμακα, το οποίο οφείλεται στον περιορισμένο επηρεαζόμενο όγκο, που βρίσκεται πολύ κοντά στον περιοριζόμενο από την περίθλαση όγκο. Πρόσθετα πλεονεκτήματα των λέιζερ περιλαμβάνουν την υψηλή απόδοση κατασκευής, απουσία αλληλεπίδρασης επαφής, εφαρμοσιμότητα σε πολλούς τύπους υλικών και αναπαραγωγικότητα. Επιπλέον, η λειτουργία των λέιζερ μπορεί να ρυθμιστεί εύκολα με τη βοήθεια προγραμματισμού σε Η/Υ ώστε να εξασφαλίζεται η κατασκευή πολύπλοκων και εξατομικευμένων δομών σε τρισδιάστατες μήτρες σχεδιασμού. Τα συστήματα αυτά προκάλεσαν μια ευέλικτη κατηγορία τεχνικών παραγωγής ικριωμάτων που βασίζεται σε τεχνικές κατασκευής στερεάς ελεύθερης μορφής (SFF) με λέιζερ. Το SFF είναι ουσιαστικά μια ταχεία τεχνική παραγωγής πρωτοτύπων που επιτρέπει τον έλεγχο των μακροσκοπικών ιδιοτήτων, όπως το σχήμα, αλλά και τη μικροσκοπική εσωτερική αρχιτεκτονική του υλικού.
α) είναι ευέλικτο και ανεξάρτητο υλικό β) είναι ταχύ, εύκολα προσαρμόσιμο και επεκτάσιμο μέσω της παράλληλης επεξεργασίας, γ) επιτρέπει τη μοναδική δυνατότητα για ελεγχόμενα, υψηλής ανάλυσης χαρακτηριστικά τόσο στη μικρο- όσο και στη νανο-κλίμακα, το οποίο οφείλεται στον περιορισμένο επηρεαζόμενο όγκο, που βρίσκεται πολύ κοντά στον περιοριζόμενο από την περίθλαση όγκο. Πρόσθετα πλεονεκτήματα των λέιζερ περιλαμβάνουν την υψηλή απόδοση κατασκευής, απουσία αλληλεπίδρασης επαφής, εφαρμοσιμότητα σε πολλούς τύπους υλικών και αναπαραγωγικότητα. Επιπλέον, η λειτουργία των λέιζερ μπορεί να ρυθμιστεί εύκολα με τη βοήθεια προγραμματισμού σε Η/Υ ώστε να εξασφαλίζεται η κατασκευή πολύπλοκων και εξατομικευμένων δομών σε τρισδιάστατες μήτρες σχεδιασμού. Τα συστήματα αυτά προκάλεσαν μια ευέλικτη κατηγορία τεχνικών παραγωγής ικριωμάτων που βασίζεται σε τεχνικές κατασκευής στερεάς ελεύθερης μορφής (SFF) με λέιζερ. Το SFF είναι ουσιαστικά μια ταχεία τεχνική παραγωγής πρωτοτύπων που επιτρέπει τον έλεγχο των μακροσκοπικών ιδιοτήτων, όπως το σχήμα, αλλά και τη μικροσκοπική εσωτερική αρχιτεκτονική του υλικού.
Η χρήση μη βιοδιασπώμενων εμφυτευμάτων αποφεύγει τις εξαρτώμενες από το ανοσοενισχυτικό παρενέργειες, ενώ παρέχει την απαραίτητη ανοσοδιέγερση στον ξενιστή [2]. Η τεχνολογία των Εξατομικευμένων Εμφυτεύσιμων Εμβολίων έχει σχεδιαστεί ώστε να επιτρέπει στα αντιγονοπαρουσιαστικά κύτταρα του εκάστοτε ατόμου να παρουσιάζουν το βέλτιστο για τον ίδιο τον οργανισμό αντιγονικό επίτοπο Σε μια τέτοια περίπτωση, η επιλογή του βέλτιστου αντιγονικού επιτόπου πραγματοποιείται με φυσικό τρόπο από τα αντιγονοπαρουσιαστικά κύτταρα, τα οποία κατά την εμφύτευση διεγείρουν τα Τ κύτταρα για ανάπτυξη ειδικής ανοσοαπόκρισης. Ο προσδιορισμός της βέλτιστης δόσης αντιγόνου in vitro είναι μια καθοριστική παράμετρος, καθώς αυτό υπαγορεύει το τύπο της ανοσοαπόκρισης. Μικρές ή πολύ υψηλές συγκεντρώσεις αντιγόνου, καθώς και οι χαμηλής ή πολύ υψηλής συγγένειας αλληλεπιδράσεις TCR-αντιγόνου-MHC θα οδηγήσουν σε ανοχή αντί για ανοσία. Παρέχοντας ολόκληρο τον αντιγονικό παράγοντα στα αντιγονοπαρουσιαστικά κύτταρα, καθορίζονται οι συνθήκες για την ανάπτυξη αντιγονοειδικών TH, Tc καθώς και Β κυττάρων.
Η εφαρμογή της τεχνολογίας του εμφυτεύσιμου εμβολίου περιλαμβάνει 5 στάδια
- Καθορισμός βέλτιστης δόσης αντιγόνου για το εκάστοτε άτομο εκτός οργανισμού: Λήψη αίματος για απομόνωση και έλεγχο λευκοκυττάρων. Η χρήση εκχυλίσματος του αντιγονικού παράγοντα εξασφαλίζει την παρουσία όλων των αντιγονικών επιτόπων, έναντι των οποίων τα κύτταρα του ανοσοποιητικού συστήματος θα είναι σε θέση να ξεκινήσουν μια κυτταρική ή/και χυμική ανοσολογική αντίδραση.
- Προσκόλληση κυττάρων στα μικροδομημένα ικριώματα πυριτίου: Λήψη αίματος για απομόνωση και καλλιέργεια των λευκοκυττάρων παρουσία του μικροδομημένου ικριώματος πυριτίου.
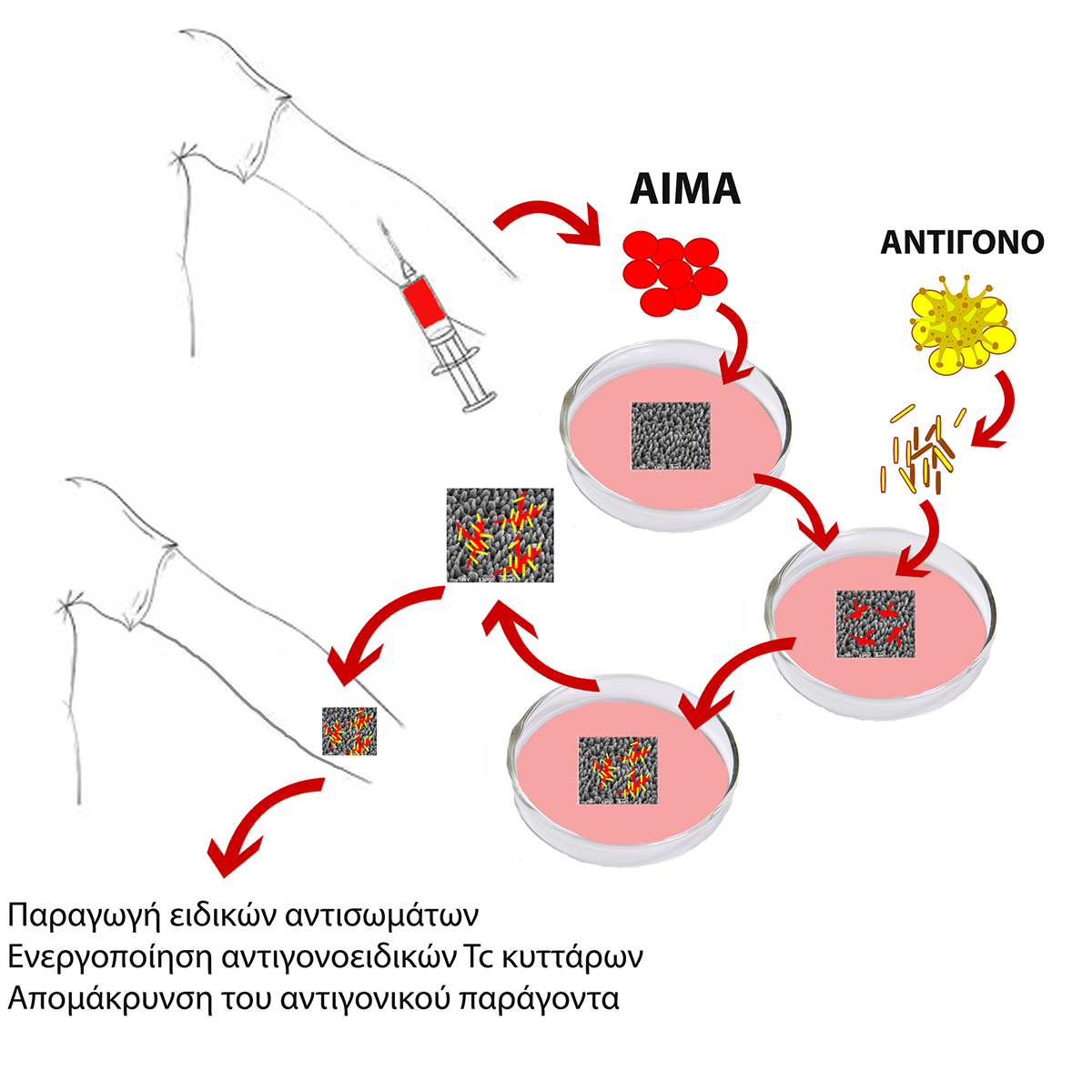
- Ενεργοποίηση των προσκολλημένων κυττάρων: Η ανοσογόνος δόση του αντιγόνου που προσδιορίζεται από το βήμα 1 παρέχεται στα προσκολλημένα κύτταρα του βήματος 2. Μετά από επώαση 24 ωρών, τα μη προσκολλημένα κύτταρα αφαιρούνται και το μέσο καλλιέργειας αντικαθίσταται με φρέσκο μέσο που περιέχει την κατάλληλη δόση εκχυλίσματος αντιγόνου, όπως καθορίζεται στο βήμα 1.
- Τελικό στάδιο προετοιμασίας του ενεργοποιημένου ικριώματος: Μετά από επώαση 24 ωρών, αφαιρείται η περίσσεια αντιγόνου, το ενεργοποιημένο ικρίωμα υποβάλλεται σε πλύσεις με καθαρό μέσο καλλιέργειας και είναι έτοιμο για χρήση.
- Υποδερμική εμφύτευση του ενεργοποιημένου ικριώματος πυριτίου και παρακολούθηση της αποτελεσματικότητας. Η αποτελεσματικότητα της διαδικασίας είναι εμφανής μία εβδομάδα μετά την εμφύτευση.


 English
English